Weniger Risiko für Blutgerinnsel bei künstlichen Herzklappen
Menschen mit mechanischen Herzklappen müssen täglich Blutverdünner einnehmen, da sie ein erhöhtes Risiko für Blutgerinnsel und Hirnschlag haben. Nun haben Forschende des ARTORG Center der Universität Bern entdeckt, wie in den Klappen turbulente Blutströmung entsteht, die letztlich zu Gerinnseln führen kann. Eine Design-Optimierung könnte dieses Risiko stark vermindern und den Betroffenen ein Leben ohne Medikamente ermöglichen.
Turbulenzen kennen die meisten aus der Luftfahrt: Bestimmte Windverhältnisse sorgen für einen holprigen Passagierflug. Aber auch innerhalb menschlicher Gefässe kann der Blutfluss turbulent sein. Turbulenzen können auftreten, wenn das Blut entlang von Gefässkrümmungen oder -kanten fliesst und dabei die Fliessgeschwindigkeit abrupt ändert. Eine turbulente Blutströmung erzeugt zusätzliche Kräfte, welche die Wahrscheinlichkeit der Bildung von Blutgerinnseln erhöhen können. Diese Gerinnsel wachsen langsam an, bis sie vom Blutstrom mitgerissen werden und einen Schlaganfall verursachen können, indem sie eine Arterie im Gehirn verschliessen.
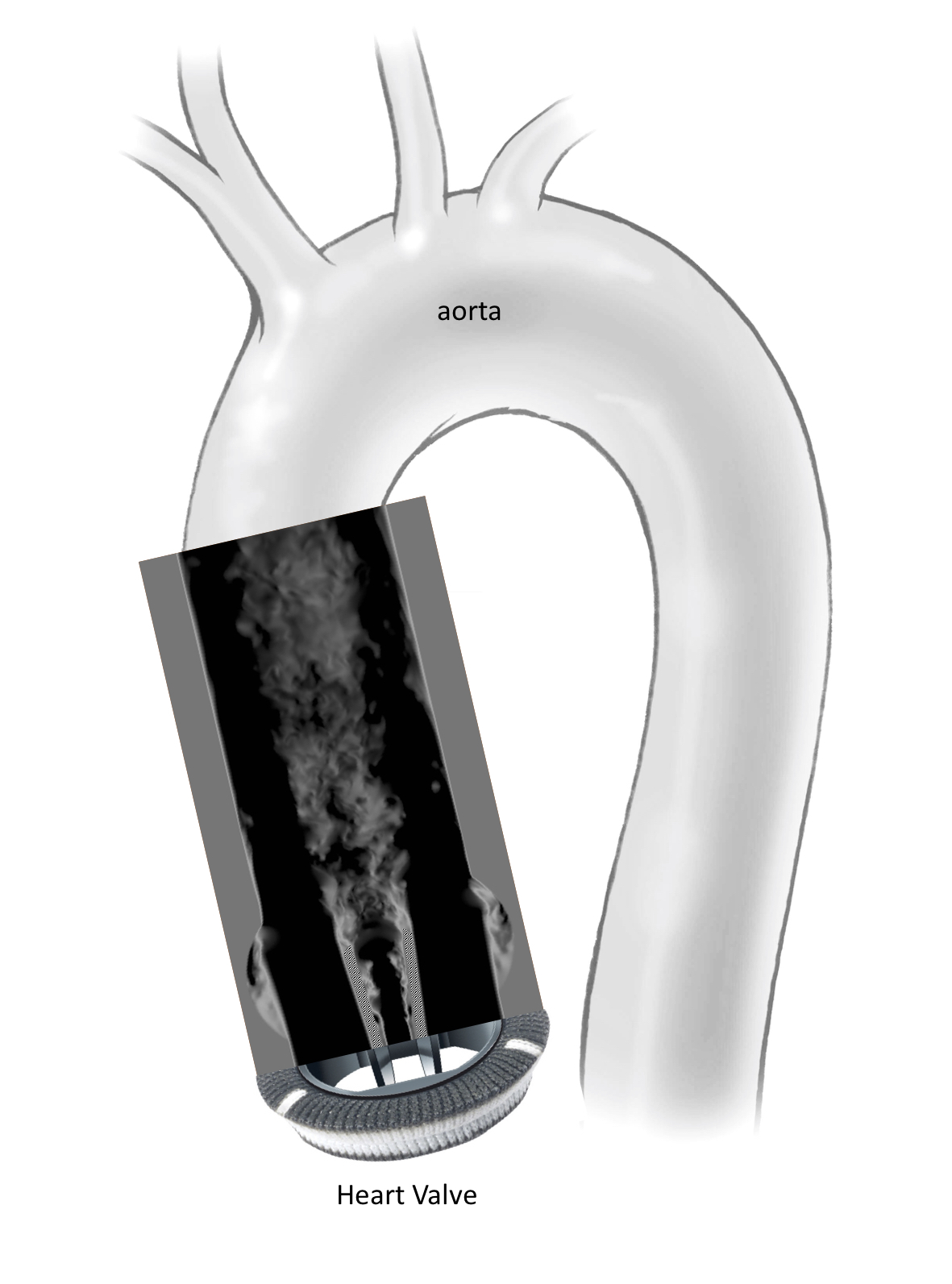
Mechanische Herzklappen erzeugen turbulente Blutflüsse
Menschen mit künstlicher Herzklappe haben ein erhöhtes Risiko für solche Gerinnselbildung. Dies ist aus der Beobachtung von Patientinnen und Patienten nach der Implantation einer künstlichen Klappe bekannt. Insbesondere trifft das bei Personen mit mechanischen Herzklappen zu, die deshalb täglich Blutverdünner erhalten, um einem Hirnschlag vorzubeugen. Unklar war jedoch bislang, warum mechanische Herzklappen die Gerinnselbildung weitaus stärker fördern als andere Klappentypen, zum Beispiel biologische Herzklappen aus tierischem Gewebe.
Zwei Ingenieure der Cardiovascular Engineering Gruppe am ARTORG Center for Biomedical Engineering Research der Universität Bern ist es nun gelungen, einen Mechanismus zu identifizieren, der wesentlich zur Gerinnselbildung beitragen kann. Dazu verwendeten sie komplexe mathematische Methoden der hydrodynamischen Stabilitätstheorie, einem Untergebiet der Strömungsmechanik, das schon seit vielen Jahrzehnten erfolgreich zur Entwicklung treibstoffeffizienter Flugzeuge eingesetzt wird. Es ist die erste Translation dieser Methoden, die Physik und angewandte Mathematik verbinden, in die Medizin.
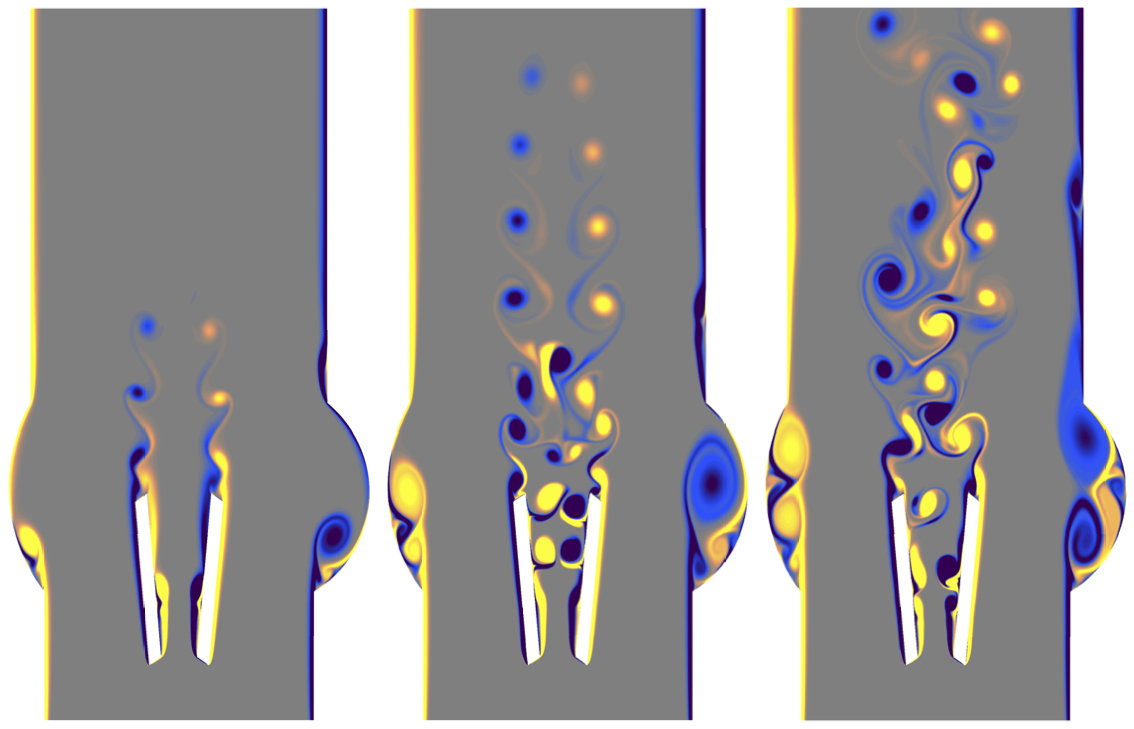
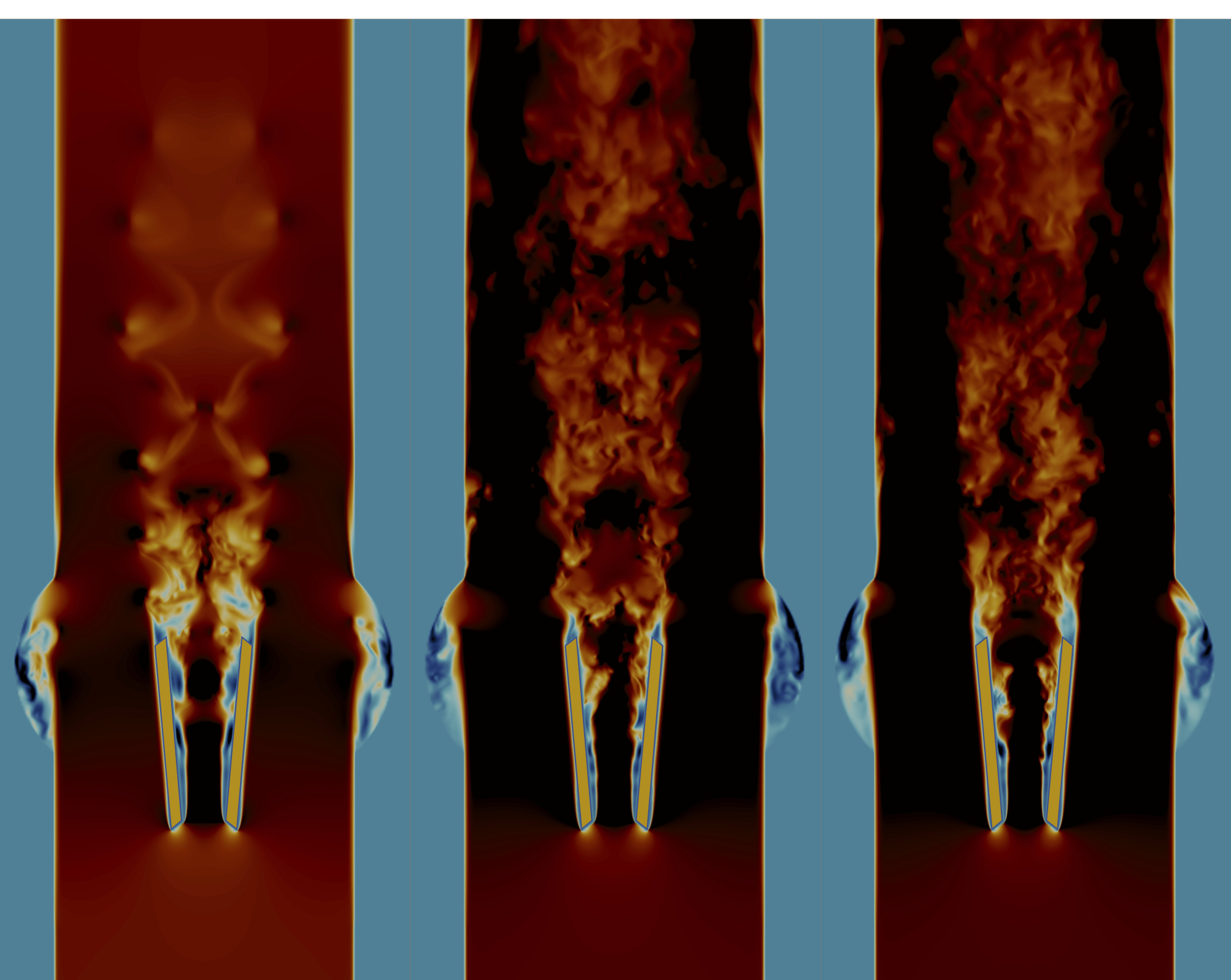
Mit aufwändigen Simulationen auf Supercomputern des Centro Svizzero di Calcolo Scientifico in Lugano konnte das Forscherteam zeigen, dass die aktuelle Form der Ventilflügel der Herzklappe zu starker Turbulenz im Blutstrom führt. «Anhand der Simulationsdaten konnten wir beobachten, wie das Blut an der Vorderkante der Ventilflügel aufprallt, und wie der Blutfluss dadurch rasch instabil wird und turbulente Wirbel bildet», erklärt Hadi Zolfaghari, Erstautor der Studie. «Durch die hohen Kräfte, die dabei entstehen, wird die Blutgerinnung aktiviert und im Rückströmgebiet unmittelbar hinter der Klappe können sich Gerinnsel bilden. Mit Hilfe von Supercomputern konnten wir eine Ursache für die Turbulenz in diesen Herzklappen aufspüren und mittels hydrodynamischer Stabilitätstheorie eine technische Lösung dafür finden.»
Die in der Studie untersuchten mechanischen Herzklappen bestehen aus einem Metallring und zwei auf Scharnieren rotierenden Flügeln, die sich bei jedem Herzschlag öffnen und schliessen und so das Blut aus dem Herzen aus-, aber nicht wieder einströmen lassen. In der Studie untersuchte das Team auch, wie die Herzklappe verbessert werden könnte. Es zeigte sich, dass bereits ein leicht abgeändertes Design der Ventilflügel das Blut fliessen lässt ohne Instabilitäten zu erzeugen, die zu Turbulenz führen – also ähnlich wie bei einem gesunden Herzen. Ein solcher turbulenzfreier Blutfluss würde die Neigung zu Gerinnselbildung und Hirnschlag deutlich verringern.
Leben ohne Blutverdünner?
Mehr als 100 000 Menschen erhalten jährlich eine mechanische Herzklappe. Wegen des hohen Risikos zur Gerinnselbildung müssen diese Menschen täglich und lebenslang Präparate zur Blutverdünnung einnehmen. Würde also das Design der Herzklappen aus strömungsmechanischer Sicht verbessert, dann wäre es künftig denkbar, dass Patientinnen und Patienten mit Implantaten gar keinen Blutverdünner mehr benötigen. Sie könnten ein normales Leben führen – ohne erhöhtes Hirnschlagrisiko und ohne dauerhafte Medikamenteneinnahme. «Das Design mechanischer Herzklappen wurde seit ihrer Entwicklung in den 1970er Jahren so gut wie nicht angepasst», sagt Dominik Obrist, Leiter der Forschergruppe am ARTORG Center. «Dagegen gab es in anderen Ingenieursbereichen, wie beispielsweise im Flugzeugbau, sehr viel Forschung und Weiterentwicklung. Wenn man bedenkt, wie viele Menschen eine künstliche Herzklappe tragen, ist es an der Zeit, auch hier über Design-Optimierungen zu sprechen, um diesen Menschen ein besseres Leben zu ermöglichen.»
Forschungsgruppe Cardiovascular EngineeringDie ARTORG-Gruppe Cardiovascular Engineering (CVE) untersucht Vorgänge und Krankheitsbilder, welche das Herz und die Gefässe betreffen, wie Herzklappenerkrankungen und Herzinfarkt. Ihre Forschung zielt darauf ab, die Langzeitbeständigkeit und Biokompatibilität von therapeutischen Anwendungen und Implantaten zu verbessern und neue diagnostische Werkzeuge für die klinische Praxis zu entwickeln. Die translationalen Forschungsprojekte der Gruppe orientieren sich an klinischen Bedürfnissen, die zusammen mit klinischen Partnern aus Angiologie, Kardiologie und Herz- und Gefässchirurgie am Inselspital identifiziert wurden. Das Team betreibt ein experimentelles Strömungslabor mit moderner Messtechnik und ein Computerlabor zur Modellierung von Strömungen im Herz und in den Blutgefässen. Zu den experimentellen Einrichtungen gehören Hochgeschwindigkeitskameras und laserbasierte Methoden zur dreidimensionalen Strömungsquantifizierung. Die Gruppe entwickelt und nutzt ausserdem massgeschneiderte Computermodelle und Supercomputer, um biomedizinische Strömungssysteme mit Fluid-Struktur-Interaktion zu untersuchen. |
Angaben zur Publikation:Hadi Zolfaghari and Dominik Obrist: Absolute instability of impinging leading edge vortices in a submodel of a bileaflet mechanical heart valve. Phys. Rev. Fluids 4, 123901, 6. Dezember 2019, https://doi.org/10.1103/PhysRevFluids.4.123901 |
13.01.2020