Neuer Schwachpunkt beim Erreger der Schlafkrankheit entdeckt
Parasiten wie Trypanosomen lösen schwere Krankheiten in Mensch und Tier aus, etwa die Schlafkrankheit. Darüber hinaus dienen sie der Forschung auch als Modellsystem, um grundlegende biologische Fragestellungen zu untersuchen. Forschende der Universität Bern haben nun aufgeklärt, wie Trypanosomen vorgehen, um bei der Zellteilung das «Kraftwerk» der Zelle gleichmässig an die Tochterzellen zu verteilen. Der neu entdeckte Mechanismus bietet mögliche Angriffspunkte für neue Medikamente.
Trypanosomen sind einzellige Parasiten, die verheerende Krankheiten beim Mensch auslösen: die Schlafkrankheit in Afrika, Chagas in Südamerika und neuerdings auch in Europa. Trypanosomen befallen auch Tiere und lösen bei Rindern in Afrika die Nagana-Krankheit aus. Für diese Krankheiten wird immer noch nach geeigneten Therapien gesucht. Forschende um Prof. Torsten Ochsenreiter des Instituts für Zellbiologie der Universität Bern haben nun die Mitochondrien, die «Kraftwerke» der einzelligen Trypanosomen untersucht und herausgefunden, dass diese sich bei der Zellteilung anders verhalten als die Zell-Kraftwerke beim Menschen. Die Erkenntnisse könnten unter anderem dazu dienen, neue Medikamente gegen die vom Parasiten ausgelösten Krankheiten zu entwickeln.
Mitochondrien sind kleine abgeschlossene Einheiten in der Zelle, die unter anderem als Kraftwerke fungieren und dem Organismus Energie zur Verfügung stellen. Ursprünglich waren Mitochondrien eigenständige Bakterien, die vor rund 1.5 Milliarden Jahren von einer Zelle aufgenommen wurden. Während des Zusammenlebens wurde das Bakterium immer weiter als Kraftwerk in die Zelle integriert, was sich etwa daran zeigte, dass die Konstruktionspläne des Kraftwerks zunehmend aus dem bakteriellen Erbgut in das der Wirtszelle verlagert wurden. Heute ist fast der gesamte Aufbau der Mitochondrien im Erbgut der Wirtszelle gespeichert. «Fast der gesamte – denn ein bisschen Autonomie haben sich die Mitochondrien bewahrt», erklärt Anneliese Hoffmann vom Institut für Zellbiologie der Universität Bern, Erstautorin der Studie. «Sie besitzen noch immer einige essenzielle Komponenten des Kraftwerks in ihrem eigenen Erbgut.»
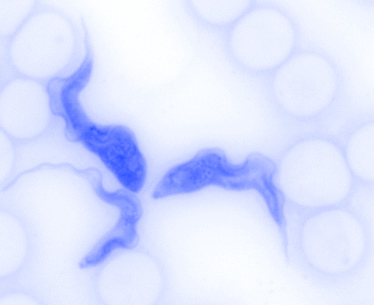
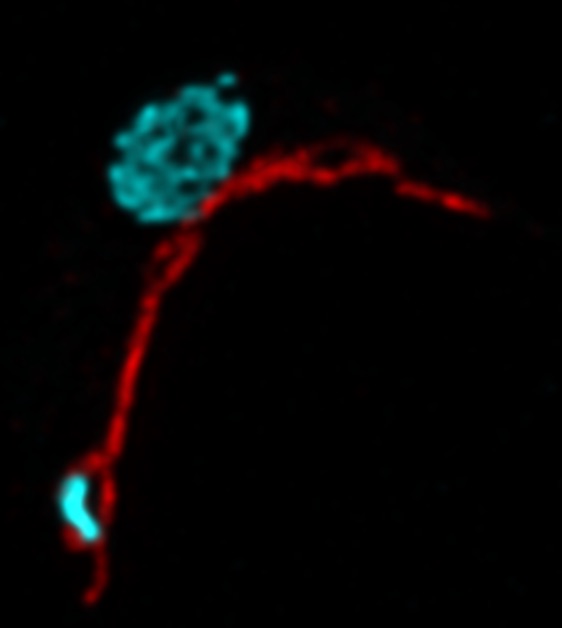
Wenn sich heute eine Zelle teilt, muss sie also nicht nur dafür sorgen, ihr eigenes Erbgut zu vervielfältigen und gerecht an die Tochterzellen zu verteilen, sondern auch dafür, dass das mitochondrielle Erbgut entsprechend weitergegeben wird. Die hierzu notwendigen Strukturen und Mechanismen waren bislang grösstenteils unbekannt. Nun haben drei Forschungsgruppen der Universität Bern in Zusammenarbeit mit der Oxford Brookes University (UK) Teile des Mechanismus entschlüsselt. Sie setzten dafür eine revolutionäre hochauflösende Technologie ein, die sogenannte «stimulated emission depletion (STED) microscopy».
Neuartiges Mikroskop
Trypanosomen eignen sich gut als Modellsystem in den Lebenswissenschaften, da sie nur ein sehr grosses Mitochondrion mit nur einem einzigen riesigen Genom (Erbgut) besitzen. Menschliche Zellen verfügen gewöhnlich über hunderte bis tausende Mitochondrien mit jeweils mehreren Genomen. Diese sehr einfache Struktur der Trypanosomen erinnert an die Situation vor 1.5 Milliarden Jahren und erlaubt es, die Entwicklung von Zellen bis zum heutigen Zustand zu analysieren. Ausserdem sind sowohl die Grösse des Mitochondriums als auch des Genoms ein Vorteil bei mikroskopischen Analysen. «Und letztlich ist es viel einfacher, einem einzigen Mitochondrion und mitochondriellen Genom währen der Zellteilung zu folgen als hunderten oder gar tausenden gleichzeitig», sagt Torsten Ochsenreiter vom Institut für Zellbiologie.
Für ihre Untersuchung nutzten die Berner Forschungsgruppen ein neuartiges Mikroskop, das es erlaubte, mit einer Auflösung von weniger als 50 Nanometer in die Trypanosomen und ihre Mitochondrien hineinzuschauen. Dabei konnten sie die Verteilung des mitochondriellen Genoms währen der Zellteilung beobachten. «Es ist uns gelungen, den Aufbau der dazu notwendigen Verteilmaschine während der Zellteilung im Detail zu beschreiben», sagt Ochsenreiter. Hierzu gehört die präzise Abfolge der einzelnen Bausteine in der Verteilmaschine, deren Grösse und Ausdehnung sowie Interaktionen untereinander. Die Wirtszelle löst dabei jeweils den Aufbau der Verteilmaschine aus, wonach jeder Baustein präzise nacheinander eingebaut wird. Anders als in bisher untersuchten Organismen scheinen Trypanosomen die meisten Bausteine exklusiv für diese Funktion entwickelt zu haben.
Auf weitere Krankheiten anwendbar
«Die Studie liefert neben den Erkenntnissen für die Grundlagenforschung auch neue Techniken, die in Zukunft auch auf andere Organismen übertragen werden können», erklärt Ochsenreiter. Zum Beispiel können damit die Ursachen für die fehlerhafte Verteilung des mitochondriellen Genoms in einigen menschlichen Erkrankungen untersucht werden, wie etwa bei Muskelerkrankungen oder auch bestimmten Krebsarten. «Insbesondere sind aber die entdeckten Unterschiede in der Verteilmaschinerie beim Parasiten und Menschen von Interesse, um neue Medikamente gegen die Schlafkrankheit und andere, von Trypanosomen in Mensch und Tier ausgelösten Krankheiten zu entwickeln.»
Die Studie wurde im Fachjournal «Proceedings of the National Academy of Sciences» veröffentlicht.
Bibliographische Angaben:Anneliese Hoffmann, Sandro Käser, Martin Jakob, Simona Amodeo, Camille Peitsch, Jiří Týč, Sue Vaughan, Benoît Zuber, André Schneider and Torsten Ochsenreiter: Molecular model of the mitochondrial genome segregation machinery in Trypanosoma brucei. PNAS, 05.02.18, doi.org/10.1073/pnas.1716582115 |
16.02.2018